一、络合滴定法(配位滴定法)
利用形成配合物(或络合物)的反应进行的滴定分析法,称为配位滴定法,也称络合滴定法。金属离子与配合剂作用生成难电离的配离子或配合分子的反应,叫作配合反应。配合剂可分为无机和有机配合剂两类;无机配合剂很早就在分析化学中应用,例如用硝酸银(AgNO3)标准溶液滴定电镀液中氰离子(CN-)的含量,反应如下:
AgNO3+2KCN K[Ag(CN)2]+KNO3
K[Ag(CN)2]+KNO3
即 Ag++2CN- [Ag(CN)2]-
[Ag(CN)2]-
随着Ag+的不断加入,与CN-配合生成难电离的可溶性[Ag(CN)2],CN-浓度逐渐减小,到计量点时,CN-几乎都变成了[Ag(CN)2]-,可由Ag+的消耗量求得CN-的含量;银离子和氰离子生成二氰合银配离子[Ag(CN)2-],当滴定到化学计量点时,稍过量的银离子与配离子生成白色沉淀,使溶液变浑浊,指示滴定终点到达。
并不是所有的配合反应都能用来进行配合滴定,作为配合滴定的反应,必须满足下列条件:
1、形成的配合物必须很稳定;
2、配合反应必须迅速;
3、形成的配合物最好是可溶的;
4、在滴定过程中,如有分级配合现象,则各配合物的稳定性应有较大的差别。
虽然能够形成无机配合物的反应很多,而能用于滴定分析的并不多,原因是许多无机配合反应常常是分级进行,并且配合物的稳定性较差,因此计量关系不易确定,滴定终点不易观察,有些反应找不到适当的指示剂,致使配位滴定方法受到很大局限。自20世纪40年代开始发展了有机配位剂,特别是氨羧配合剂与金属离子形成组成一定、稳定性很大的配合物,克服了无机配合剂的一些缺点,在分析化学中得到了日益广泛的应用,从而推动了配合滴定法的迅速发展。
目前常用的有机配位剂是氨羧配位剂,它是一类含有氨基和'基的有机配合剂,其中以EDTA应用最广泛。
二、金属指示剂
常用的金属指示剂如图所示
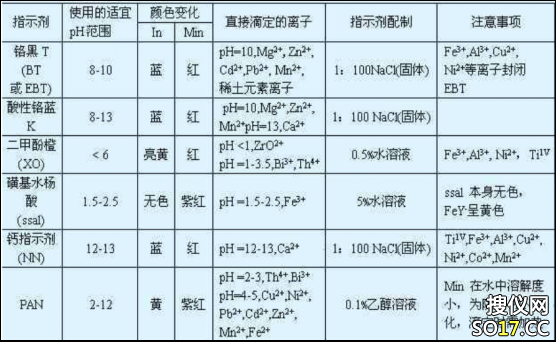
主要介绍以下两种:
1、铬黑T(简称BT或EBT)铬黑T的钠盐为褐色粉末,带有金属光泽,使用时最适宜的pH范围是9~10.5。在测定水总硬度时常用铬黑T做指示剂,到达滴定终点时,溶液颜色由紫红色变成蓝色,且变色相当明显。
铬黑T不溶于水,但能溶于甲醇或乙醇中。配成溶液后,由于空气的氧化作用会渐渐失效,但加入还原性保护剂(如抗坏血酸或盐酸羟胺),则可延长其使用时间。
铬黑T常与NaCl或KCl等中性盐按1:100的比例混合研细,然后保存于干燥器中,这样可以延长使用期。使用时用药匙取约0.1g,大约相当于铬黑T1mg。
2、钙指示剂(简称BB)钙指示剂为紫黑色粉末,很稳定。但其水溶液、乙醇溶液均不稳定,常与干燥的NaCl、KCl(1:100)配成固体指示剂,称之为钙红。固体指示剂也能逐渐氧化,放数月后色素浓度减少10%~20%,但分解产物不影响指示剂的变色。
钙指示剂在pH=12~14范围内是蓝色,它与钙离子(Ca2+)生成紫红色的配离子,常用于Ca2+、Mg2+离子共存时Ca2+离子的测定。测定时,调节溶液pH=12,生成Mg(OH)2沉淀从溶液中除去,故可直接滴定钙离子。为减少沉淀对指示剂的吸附,一般应在沉淀Mg(OH)2 后再加指示剂。到达终点时,溶液由紫红色变为纯蓝色。
来源:实验与分析
蒸汽闭锁阀-不锈钢密闭量油尺连接球阀快速接头

LB6411中子剂量率探测器德国伯托BERTHOLD

LB6500-4-H10剂量率探头德国伯托BERTHOLD

LB761低本底放射性测量仪德国伯托BERTHOLD

LB134剂量率监测器德国伯托BERTHOLD

LB2046便携式αβ测量仪德国伯托BERTHOLD

LB761低本底放射性测量仪德国伯托BERTHOLD

LB790低本底放射性测量仪德国伯托BERTHOLD

LB1343污染测量仪德国伯托BERTHOLD

LB147手脚衣物污染监测仪德国伯托BERTHOLD