
药品是特殊的商品,医药产业也是特殊的产业;医药产业的发展规律除了与宏观经济相关,更受到国家政策法规的影响,作为医药产业的源头—医药研发(R&D),其发展变化轨迹,更是与药品审评政策、注册管理办法的变化息息相关。
上世纪九十年代至今,本土的医药研发从最初的“仿标准”,到如今的“质量源于设计”之研发理念深入人心,从单纯的仿制到摸索着创新,走过了一段崎岖又艰难的道路。笔者试着从不同角度对医药研发做一番梳理。
一、医药研发历史脉络分析
1.本土医药研发历史脉络分析
1998年之前,药品审评属于卫生部管理,研发处于孕育期;
1998年4月,组建国家药品监督管理局,并于1999年5月颁布实施《新药审批办法》,标志着药品研发进入萌芽期,该阶段,新药的概念是未在国内生产的药品就是新药,外国公司在国外生产并且进口到中国的药品,中国仿制了也是属于新药。这个阶段的药品研发技术水平很低,懂研发的技术人员也非常稀缺,主要集中在高校和国有研究机构,由于没有形成市场化,研发也相对比较规范。
2002年12月份颁布了《药品注册管理办法》(试行版),医药研发进入了成长期,由于这个办法将改变剂型的药品也作为新药,于是导致了所谓的改变剂型的“新药”泛滥成灾,比如片剂改胶囊、分散片、颗粒,小针改冻干粉针、大输液,大量的中药保护品种被改剂型,北京、南京、济南三个城市的研发公司最多,很多药品的代理商也开始委托研发公司改剂型注册药品批文。
2005年5月1日,《药品注册管理办法》正式版实施。2005年春,药品研发进入了最后的疯狂,几乎很少有企业肯埋头做试验,都进入了编造数据、复印资料的阶段。随着2006年郑筱萸、曹文庄等人的出事,药品研发行业重归于沉寂。
2006年,药监局局长、司长落马,药监局进入了过渡期品种整理阶段,这个阶段全国进行了政治运动式的注册大核查,绝大多数的品种都被退审。对国内的医药研发是个毁灭性打击。
2007年,邵明立上台后,新的《药品注册管理办法》出台,改变剂型不再是新药,药品的审评开始向国际靠拢,审评的尺度非常严格,门槛也大大提高。

2.历史总是惊人的相似——与美国药品监管的历史对比
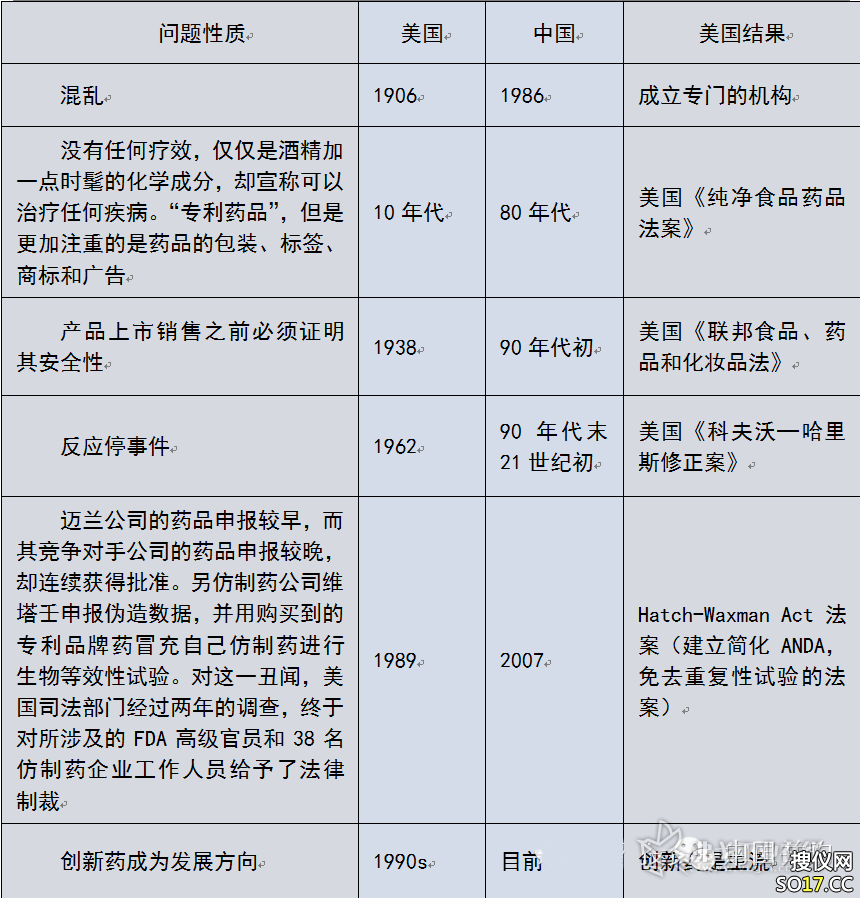
我们国家上世纪80年代与美国1910年之前非常相似,都是药品管理非常混乱;
我们在1990年之后才开始关注药品上市前的安全性问题,美国是1938年通过了《联邦食品、药品和化妆品法》;
特别是1962年的反应停事件,对于世界影响非常大,美国通过了《美国《科夫沃—哈里斯修正案》。
1989年通过的《药品价格竞争与专利期补偿法》,在维护原研药物企业利益与鼓励仿制药企业之间进行了协调平衡,特别是此案颁布后,仿制药企业无需按照创新药物的要求进行研发,而仅仅进行简化申请和生物等效性试验即可,大大降低了研发成本和仿制药的上市时间。
目前,我们国家也开始提倡创新药物的研发,与1990年的美国接近。
二、医药企业研发模式分析
1.医药企业研发模式分类
(1)购买批件型
2010年以来,有价值的生产批件转让几乎绝迹;有价值的临床批件,也越来越难以寻觅,当然也有为数不多的研究机构在获得临床批件后进行转让,转让价格往往被追高。所以购买临床批件或生产批件难以成为企业获得新产品的常态。
(2)委托开发型
2000年以来,委托开发是中国医药企业获得新产品的主要方式。很多医药企业在研究所的项目处于立项阶段或药学研究阶段时就开始介入新产品开发。这种前期介入,具有研发投入少、项目选择余地大的优点,但也具有风险大的缺点;风险大一般体现在研究所的诚信度、项目的立项风险、项目的开发风险等方面。委托开发型又分为“广泛撒网型”和“目标锁定型”。
医药企业在研发初期往往采用广泛撒网型,到处选择研发结构,每家研发机构委托开发1-2个项目;2-3年之后,根据项目开发的质量,往往会锁定1家研究所,进行长期战略合作。当然研究所也乐意有一家或几家企业与之进行战略层面的合作。
如果某企业成为研究所的大客户,该研究所自然会对该企业的所有开发品种高度重视,无论是公司资源还是项目立项,都会向该企业倾斜,某种程度上,该研究所将慢慢成为该企业的专属研究机构。
(3)参股合作型
参股研究所是“委托开发”之“目标锁定型”的深入合作类型。随着企业对研究所及其负责人的交往和了解,一些有长远发展眼光的企业会根据自身的实力物色与之匹配的研究机构进行参股合作。这种合作属于战略型合作,并非为了几个新产品的开发,意义深远!
对于企业来说,选定一家研究机构进行参股或控股,该研究所会为根据企业的生产线和营销战略度身定做新药项目,由于研究机构保持其独立性,在与外界不间断交流的同时,还充满活力。
就规避新药开发的风险而言,参股研究所属于最低风险,首先,研究所不再为生存而担忧,自然会专心做研究工作,会大大提升研发质量,审评通过率也会大大提升;其次,企业是研究所的重要股东或大股东,研发资源的分配上,企业具备话语权,即便项目失败重复研究,研究所也会优先照顾自家股东企业。
(4)自主研发型
这是少数大型制药企业的选择,企业内部的研究院近千人,不仅具有完整的研发团队,还具有临床试验队伍、动物试验基地。但由于管理成本巨大,研发效率普遍低下,因此“自主研发型”非中小型制药企业的选择。
2.医药企业研发模式发展路径
购买批件几乎是所有企业的首选途径,但往往好的批件转让价格高,为了减少费用,往往还会采用“委托开发”,由于对研发公司不熟悉,开始一般都是广泛撒网,鸡蛋不会放在一个篮子里,后期经过项目合作,则会选择固定1-2个研发公司进行定点合作,既增加谈判砝码,更有利于形成增进互信,长期下去,还有可能发展成参股合作型。
还有些企业具备一定实力后,也会自建研发中心,进行自主研发,但一般来说,自主研发效率如果不高,还是会同时采用购买批件和委托开发,几种模式并行的方式。
三、独立研发公司研发模式分析
1. 国外独立研发公司发展路径
在国际医药巨头的笼罩下,一般国外的独立研发公司发展路途经有两条,一条是通过专利技术的授权许可与大型药厂合作,或者通过并购联盟的方式成为核心公司;另一种方式是通过“边缘产品”(一般是孤儿药)进入医药产业链中,最著名的是以色列梯瓦公司,国外有罕见病治疗法案,政府在税收、注册等很多方面鼓励企业开发孤儿药物。我们国内的罕见病治疗法案目前还在酝酿之中,迟迟没有出台。
2.本土独立研发公司研发模式分类
(1)委托开发型
目前国内中小型独立研发公司中,委托开发型占据主流,估计80%以上,这类研发公司规模较小,人数在10-20人,年销售额不超过200万。这类研发公司基本具备比较稳定的研发团队,但由于创业起步属于自力更生,只能靠接收委托订单获取研发资金,而随着技术审评门槛的逐步提高以及人员工资福利的大幅提升,项目开发经费不断上涨,导致研发利润稀薄甚至亏损情况时有发生。
(2)自主申报型
这类公司的负责人一般是研发出身,也是类型(1)转型首先考虑的方向,这类公司也是当前最专业的研发团队。而依靠自主申报类型真正发展壮大起来的企业,一般是在2006年以前完成了原始积累,拥有雄厚的资金、人才和项目研发实力。其主要盈利点为高价转让新药临床批件(生产批件)。
由于早早的完成了资金原始积累,并且在2006-2009年期间,默默的进行人才、技术和项目储备,在2010年以后积累了不少项目批件,既可以转让批件获取客观的利润,又可以委托加工转型进入“研发营销互动型”,未来发展前景非常广阔。
(3)研发-化工联动型
2006年医药研发洗牌之后,很多研发公司尝试到医药化工中间体领域,但成功的很少,在医药化工中间体的领域,其佼佼者多数是化工出身,而非从事医药研发转型过来。
少数从医药研发转型到医药化工领域的成功者,其公司负责人一般精通合成工艺研究,他们的优势是化学合成领域,包括中试和生产工艺放大。其盈利模式一般是以医药化工中间体的销售利润养自主研发,临床批件转让后获取利润;并且在项目转让后药厂从该企业购买医药中间体来获取源源不断的稳定收益。
(4)研发-营销联动型
这类公司从市场营销的角度选择药品项目,自己的研发团队为营销服务,掌握了“研发-营销”,这是掌握医药行业核心的企业,也是颇具竞争力的企业,这类公司有的是从营销切入研发,有的是从研发转型到营销,但前者的成功比率远大于后者。
这类公司的模式是自主开发项目,委托熟悉的制药厂进行生产加工,产品上市后自己做全国总代理,在全国分地区进行招商。这种公司的模式发展潜力很大,但存在潜在的隐患,就是品种落户后与药厂的关系处理。
由于研发型负责人不懂营销,不与营销团队合作而冒然进入销售领域,能真正从医药市场中获利的企业比较少。
(5)药企参股型
2006年之后,不少研发公司寻求与药企参股合作,这是一种共赢的模式,药企每年固定投入新产品开发,研究公司除了开发合作药企的项目,还可以自主开发或接收委托开发。如果药企保证有固定开发投入,研发公司可以安心从事项目研发,研发的规范性和成功率必然会大大提升。
(6)药企收编型
2006年之后,也有少数研发公司或研发负责人将自己团队或者自身完全由药企收购,成为药企的研发总监或研发中心,发展计划和发展思路完全由药企主导。严格说来,这类公司的独立性已经消失,也失去了项目开发的热情和动力。

3. 本土独立研发公司发展路径图

四、第三方研发监理的模式分析
1. 独立研发公司存在价值
独立研发公司以年轻创业者为主,往往在某个技术领域(如化学合成、制剂、分析或注册)具有优势,管理灵活多样,信息灵敏,反应快速,经常在某一个较窄的药品研发领域取得优势地位,吸引到大企业与之合作;独立研发公司不断涌现也是推动医药研发甚至医药产业不断前进的动力之源。
2. 独立研发公司的弱势
大部分独立研发公司具有先天的弱势,比如中试研究(大生产)薄弱,信誉度不高,隐瞒技术漏洞、隐瞒批件风险等等。
3. 医药企业与研发公司合作常见问题及原因分析
(1)技术工艺交接问题(签合同前了解不清楚)
(2)临床批件立题隐患(购买批件前对项目了解不深刻)
(3)项目退审纠纷(申报前技术资料的把关)
(4)委托开发项目申报延期(过程控制跟踪不到位)
4. 第三方研发监理的意义
在很多其他行业领域,随着产业分工的发展演变,甲方与乙方之外,往往还有一个第三方监理,对受委托方的项目进行过程监管和质量验收,甚至参与到合同洽谈之中。而在医药研发领域,由于第三方监理的缺失,往往导致甲乙双方在项目合作过程中信息不对称,难以及时发现问题和解决问题。
如果能够在项目立项把关(审评政策、上市信息),合作研发公司的深度调研,项目研发过程控制(关键环节的控制与验收)等方面为医药项目进行监理,则能大大提高项目投资的成功率!
来源:实验与分析
蒸汽闭锁阀-不锈钢密闭量油尺连接球阀快速接头

LB6411中子剂量率探测器德国伯托BERTHOLD

LB6500-4-H10剂量率探头德国伯托BERTHOLD

LB761低本底放射性测量仪德国伯托BERTHOLD

LB134剂量率监测器德国伯托BERTHOLD

LB2046便携式αβ测量仪德国伯托BERTHOLD

LB761低本底放射性测量仪德国伯托BERTHOLD

LB790低本底放射性测量仪德国伯托BERTHOLD

LB1343污染测量仪德国伯托BERTHOLD

LB147手脚衣物污染监测仪德国伯托BERTHOLD